CLOREXIDINA E CLORO NA LAVANDERIA:
O QUE ACONTECE NA REALIDADE?
Prof. Roberto Farias[1]
Prof. Fabiano Alves[2]
Introdução
A clorexidina foi desenvolvida (1940) pela "Imperial Chemical Industries ltd., Macclesfield, England". Como agente antiviral, fracassou, mas foi redescoberta, anos mais tarde, como agente antibacteriano.
Os sais originalmente produzidos (chlorhexidine acetate e chlorhexidine hydrochloride) apresentavam baixa solubilidade em água e foram substituídos pelo chlorhexidine digluconate ou digluconato de clorexidina (BARBIN, E. L, 2008).
O digluconato de clorexidina (CHX) é um antisséptico de comprovada eficácia antimicrobiana com aplicação terapêutica na odontologia; na assepsia de equipamentos, superfícies e mãos nas indústrias que manipulam produtos de origem animal; na limpeza de lentes de contato e nos procedimentos que exigem introdução de cateteres.
Seu uso exige monitoramento considerando a formação de derivados de para-cloroanilinas (PCA), dotados de potencial cancerígeno /mutagênico.
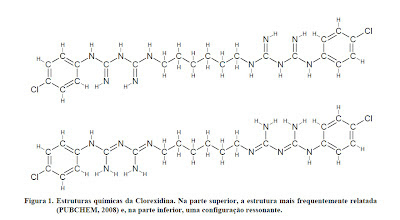
A CHX é um sal cujo íon positivo é a clorexidina "C22H30Cl2N10" com massa molecular de 505,4460 g/mol, massa monoisotópica de 504,2032 Da (Dalton) e número de registro CAS "55-56-1". (Yeung et al., 2007; Wishart et al 2007; Pubchem, 2008). A estrutura química da CHX pode ser ilustrada na Figura 1.
Segundo Barsani, Fillery, Manek, Manzur (2007), Barbin (2008), a combinação da CHX com alguns tipos de produtos provocam reações que podem formar precipitados de variadas colorações - do branco ao âmbar – mediante o pH, temperatura e presença de alguns compostos químicos.
Dentres esses compostos que reagem com a clorexidina está o Hipoclorito de Sódio (NaOCl) largamente utilizado nos serviços de saude (higiene e limpeza) e lavagem de roupas (alvejamento e desinfecção química).
Na lavagem de roupa o NaOCl foi substituido pelo Peróxido de Hidrogênio (H2O2), com o objetivo de eliminar esses inconvenientes no enxoval, principalmente hospitalar.
O incomodo dessa substituição apresenta-se pelo maior preço do produto e a necessidade de temperatura elevada. Com relação ao meio ambiente é muito menos agressivo que o NaOCl.
Objetivos da pesquisa
Determinar a concentração mínima de NaOCl que provoca a mudança de cor, a formação de precipitado, caracterizar o precipitado resultante e identificar e conhecer os fatores dessa reação na roupa da hotelaria, serviços de saúde ou na lavanderia.
Método da pesquisa
A pesquisa é experimental, descritiva e elaborada em duas fases: a primeira, bibliográfia e documental com base no trabalho de Barsani, Fillery, Manek, Manzur (2007) que foi verificar a mistura simples da solução padrão de CHX sobre soluções de NaOCl e a segunda, realizada pelos autores, com tecidos embebidos com CHX e processados com soluções variáveis de NaOCl. Foi utlizada também uma solução de Hidróxido de Sódio (NaOH) como comparativo e associação da alcalinidade na reação.
As soluções atendem ao trabalho de Barsani (2007): CHX padrão a 2% v/v; NaOCl a 6% p/v e Manzur (2007): NaOH 10% e água destilada.
Desenvolvimento
Fase 1 (Barsani et al) – Resumo:
Selecionados 09 tubos com concentrações de NaOCl: 6,0%, 3,0%, 1,5%, 0,75%, 0,38%, 0,19%, 0,094%, 0,047% e 0,023%. Para determinar a concentração mínima de NaOCl em que a mudança de cor ocorreu, e um precipitado foi formado foi adicionado 0,5 ml de CHX a cada um dos 9 tubos contendo NaOCl conforme mostra a Figura 3 a seguir:
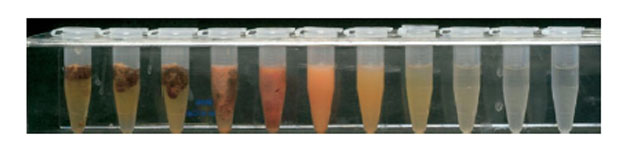 Figura 3. A concentração de NaOCl diminui de 6,0% (tubo 9) a 0,023% (a partir de tubo 9 à esquerda) e os tubos com NaOCl a 6% e CHX a 2%, respectivamente.
Figura 3. A concentração de NaOCl diminui de 6,0% (tubo 9) a 0,023% (a partir de tubo 9 à esquerda) e os tubos com NaOCl a 6% e CHX a 2%, respectivamente.
Resultados: Altera a cor e forma precipitados
A mudança de cor ocorreu em todos os tubos onde a CHX foi adicionada, incluindo o tubo com concentração mais baixa de NaOCl 0,023%. A cor variou e não se alterou com o tempo. A mais baixa concentração de NaOCl a induzir um precipitado foi de 0,19% (tubo 4). Com a alteração da cor, o precipitado ocorreu imediatamente e não mostrou nenhuma mudança com o tempo.
Fase 2 Resumo:
Selecionadas 6 peças de algodão (100%) que ficaram imersas na solução de CHX por 30 minutos e secos ao ar por 24 horas. Foi preparada as soluções de NaOCl nas concentrações de 1,50%, 1,20%, 0,90%, 0,60%, 0,30%, 0,10%. Os tecidos foram imersos por 20 minutos, retirados e lavados com água destilada e secos ao ar. Depois de secos foram imersos parcialmente nas soluções cloradas por 20 minutos.
A coloração ocorre quase que imediatamente e não sofre alteração depois de formada conforme mostra a figura 4 a seguir:
 Figura 4. A coloração é maior com o aumento da concentração de NaOCl.
Figura 4. A coloração é maior com o aumento da concentração de NaOCl.
A solução, conforme trabalho de Barsani et al., também mostra precipitados com a mistura CHX e NaOCl conforme a figura 5 a seguir:
 Figura 5. A formação do precipitado na solução de CHX e NaOCl.
Figura 5. A formação do precipitado na solução de CHX e NaOCl.
A solução com menor concentração de NaOCl é mais laranja e a com maior concentração é mais clara, o que mostra que quanto maior a relação NaOCl na CHX maior a precipitação e a redução da cor da solução conforme mostra a Figura 6 a seguir:
 Figura 6. A formação do precipitado na solução de CHX e NaOCl.
Figura 6. A formação do precipitado na solução de CHX e NaOCl.
Pode-se concluir nessa fase que quanto maior a ocorrência dos precipitados maior é a coloração na roupa. A ocorrência dos precipitados pode sugerir que estes sejam o principal agente de coloração nas roupas nas lavanderias.
A literatura informa que, além do NaOCl, outros compostos provocam reações com a CHX e que podem colorir a superfície (nesse caso, a roupa) em diversos tons do branco ao amarelo claro. Fato verificado em algumas lavanderias que não utilizam cloro e descrevem o surgimento de “manchas” amareladas, mais fracas, porém de difícil remoção.
Algumas manchas podem ter origem na combinação do uso da CHX e do NaOCl utilizado na limpeza hospitalar, conforme menção feita num artigo anterior publicado na revista Anel 195 (set/out de 2010, p. 34 a 38). A ocorrência desse fato é possível, porém investigações mais aprofudadas devem ser realizadas para confirmar essa hipótese.
A reação CHX + NaOCl pode ser considerada como novo produto, agora sob a fórmula NaC6H4Cl.
Barbin (2008) afirma que a estrutura da CHX, meio alcalino e pH elevado (Hidróxido de Cálcio – Ca(OH)2), pode provocar precipitados e ser a causa da provável decomposição da CHX em radicais livres e PCA. Nas análises realizadas foi contatada que a solução de CHX isolada foi decomposta em diferentes subprodutos, inclusive em PCA.
Para verificar essa afirmação avançamos na pesquisa, porém substituindo o Ca(OH)2, pelo NaOH que é utilizado nas formulações dos aditivos alcalinos.
Foi utilizada a CHX padrão e adicionado NaOH a 10% por gotejamento (1 ml por vez). Ocorreu a formação de precipitados de cor branca na solução.
A solução foi filtrada duas vezes em tecidos de algodão. 1ª reteve o precipitado. Em seguida a 2ª filtração noutra amostra de tecido. Os precipitados da 1ª filtração são brancos cristalinos. No tecido, reagem em presença do NaOCl conforme mostra a figura 7 a seguir:
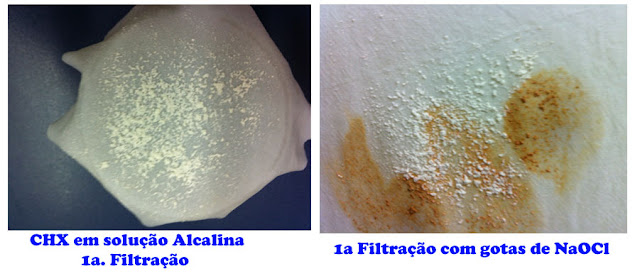 Figura 7. A formação do precipitado na solução de CHX e NaOH e depois NaOCl.
Figura 7. A formação do precipitado na solução de CHX e NaOH e depois NaOCl.
Esse resultado direciona o precipitado como o agente que provoca a coloração na roupa em reação com o NaOCl.
Na 2ª filtração, (2ª amostra), com a solução sem os precipitados, é adicionado NaOCl a 10% 3ª amostra). A reação que ocorre no tecido é quase imperceptível. A coloração (âmbar) característica (CHX + NaOCl) aparece quando o NaOCl é adicionado diretamente sobre os precipitados conforme mostra a sequência da Figura 8 a seguir:
Figura 8. A formação do precipitado na solução de CHX e NaOH.
Esse resultado confirma o precipitado como agente que provoca a coloração na roupa em reação com o NaOCl. Esse precipitado, segundo a literatura pesquisada, contém PCA.
Caracterização do precipitado.
A PCA identificada no precipitado está diretamente relacionada à concentração de NaOCl e do NaOH utilizado na mistura.
Discussão / Conclusão:
Os resultados obtidos indicam que, quando misturado com o NaOCl ou outros compostos como o NaOH, a CHX torna-se hidrolisada em fragmentos menores, formando um novo subproduto. Supõe-se que estes fragmentos precipitados contém PCA.
A pesquisa conclui que o NaOCl, mesmo em baixas concentrações (0,023% ou 2,3 ml por quilo de roupa) na lavagem ou na água tratada (cloração não controlada) pode ocorrer a “coloração” na roupa. A reação deve ser evitada pela coloração na roupa e pela formação de derivados PCA, dotados de potencial cancerígeno /mutagênico.
A PCA não deve ser considerada como uma “mancha” já que é resultante da formação de um novo produto (CHX + NaOCl) de coloração âmbar. O que ocorre no tecido não é uma mancha, mas o tingimento pela “coloração” da PCA (considerada uma anilina), resultante dessa reação. Porém, o que pode ser novo é que o precipitado ocorre também na ausência do cloro.
Foi possível verificar a formação de precipitados brancos da PCA no meio alcalino e temperatura elevada, ou seja, ocorre também no processo de lavagem alcalina (pH alto e temperatura maior que 60/70ºC).
Portanto mesmo lavando sem NaOCl, esses precipitados não removidos podem provocar coloração com o Cloro residual de águas tratadas com cloro.
Como solucionar se pode ocorrer também com outros agentes de lavagem embora de forma menos agressiva?
A partir da identificação dos precipitados é possível avançar na pesquisa. Sugere-se maior investigação sobre o composto, já precipitado, na roupa.
DISCUSSÃO / CONCLUSÃO:
A pesquisa teve por objetivo estudar o fenômeno da reação da CHX + NaOCl e outras influências que podem contribuir na formação da mancha na roupa no processos de lavagem.
De acordo com os resultados foi possível verificar:
a) A CHX + NaOCl ou a CHX + outros compostos Alcalinos (Ca(OH)2; NaOH forma fragmentos caracterizando um novo subproduto. Supõe-se que estes fragmentos precipitados contém PCA.
b) A coloração da PCA é variável do Branco (CHX + NaOH) ao âmbar (CHX + NaOCl).
c) Não ocorre "uma mancha" no tecido, mas um tingimento devido a "coloração" da PCA (considerada uma anilina) pela mistura da CHX + NaOCl).
d) A mistura da CHX + NaOCl, mesmo em baixas concentrações 0,023% ou 230 ppm (partes por milhão) ou 2,3 ml / kg de roupa provoca a "coloração" ma roupa.
e) O excesso de residual de NaOCl na água tratada (supercloração), lavagem inadequada das caixas de água podem provocar a "coloração" na roupa na presença de CHX.
f) O precipitado branco (CHX + NaOH) provoca mancha, porém em menor intensidade de cor (levemente amarela). Podem ocorrer no processo de lavagem alcalina (pH alto e temperatura maior que 60/70ºC).
g) Os precipitados brancos não removidos da roupa podem provocar coloração posterior se em contato com NaOCl.
Algumas hipóteses ainda carecem de respostas científicas. Tudo é muito novo para o setor de lavanderias. No passado recente o mercado alegava que as manchas eram provocadas na lavanderia. Em seguida surge a afirmação de que a "mancha" é uma "tintura".
Essa pesquisa pode corroborar que a "tintura" é um subproduto (PCA) formado pela reação CHX + NaOCL e que pode ser o responsável por esse fenômeno.
O que se pode afirmar, com base nessa pesquisa é que: O uso da CHX trouxe benefícios ao serviço de saúde (maior eficiência e menor custo) e para a lavanderia, a imposição pelo uso do Peróxido de Hidrogênio (H2O2) (maior custo). A necessidade de reajuste no preço cobrado é evidente e não significa falha na gestõa da lavanderia.
A comunicação ética (transparência e clareza) entre a lavanderia e o hospital pode reduzir os índices de manchas. Os hospitais devem informar que tipos de peças podem conter CHX. A lavanderia não pode utilizar o NaOCl nestas peças.
A falha na comunicação pode comprometer os resultados e a culpa da "coloração" passa a ser totalmente do serviço de saúde e não da lavanderia.
Avançar ainda mais nas pesquisas é necessário, principalmente quando existe a sugestão de que a reação CHX + NaOCl e outros deve ser evitada por causa da formação de derivados PCA, dotados de potencial cancerígeno/mutagênico. Sugere-se maior investigação sobre o composto, já precipitado na roupa.
Na lavagem de roupa outras respostas merecem pesquisas com afinidade na metodologia científica para suprir as questões: como evitar as manchas utilizando o NaOCl? Qual a desvantagem de não utilizar o Peróxido de Hidrogênio (H2O2)?
Qual o impacto ambiental maior? A temperatura necessária para o H2O2 ou a adição de compostos clorados no ambiente? Como evitar o precipitado na lavagem? Quais os riscos desses precipitados para os operadores e usuários? É possível classificar a roupa hospitalar "com e sem" CHX?
O mercado de químicos fala de produtos inibidores / neutralizadores da CHX e recomenda a aplicação do NaOCl no processo de alvejamento/ desinfecção. Vale a pena avançar nesse processo? quais as vantagens? E os riscos? Qual é a economica? qual o impacto ambiental? Qual a interferência na vida útil dos tecidos?
Qualquer procedimento considerado "novo" deve ser avaliado sobre 04 (quatro) aspectos: O Homem (custo da satisfação), o Econômico (custo da escassez), Financeiro (custo do benefício) e o Ambiental (custo social). As inovações que não atendam a esses pré-requisitos são consideradas inúteis, segundo Schumpeter.
A lavanderia precisa avançar em conhecimento, todo o seu ambiente externo mudou. A estática gera a entropia, tende ao canibalismo e ao desaparecimento precoce.
[1] Autor dos livros manual de segurança na higiene e limpeza (2011), manual para lavanderias (2006), Professor na pós graduação no Instituto Hospital Albert Einstein, Mestre em Administração.
[2] Doutor em Engenharia Química, Prof. Faculdades Oswaldo Cruz, Diretor Técnico da CMA Especialidades Química.